广州科适特科学仪器有限公司代理商
10 年
手机商铺
- NaN
- 0.6000000000000001
- 1.6
- 0.6000000000000001
- 3.6
推荐产品
公司新闻/正文
手把手教你高效完成细胞免疫荧光染色
3019 人阅读发布时间:2025-09-10 18:37
师弟:师姐!我最近做荧光染色实验都快崩溃了……细胞爬片太考验我的耐心和技术了,细胞分布全看运气,成像效果也不咋行,抗体快浪费不起了啊!
师姐:当年我也是这样过来的,不过现在可以试试 ibidi µ-Slide VI 0.4 六通道载玻片。免疫荧光染色步骤大大简化,不仅细胞分布的更均匀,换液染色也不担心细胞被污染,而且一张玻片就能完成 6 次重复,还巨省抗体,一个孔 30 μl 就够!还能做细胞灌流实验呢!
师姐:你也在为荧光染色实验细胞分布不均、成像效果差和试剂成本高发愁吗?ibidi µ-Slide VI 0.4 六通道载玻片,独特通道设计能消除培养基弯液面,保证细胞均匀分布,只需 30 μL 抗体溶液就能填满通道,大大降低试剂消耗,用高成本抗体也不心疼!高通量并行实验首.选,文末领取免费试用机会,还有同款单通道载玻片,也可免费申请试用!
手把手教你高效完成细胞免疫荧光染色
(以 HT-1080 细胞为例)
1、培养细胞
建议提前一天将 ibidi µ-Slide 通道载玻片和细胞培养基置于培养箱内以平衡气压。
收集细胞悬液,调节细胞密度至 1×103 cells/ml,载玻片的每个通道中迅速加入 30 µL 细胞悬液。
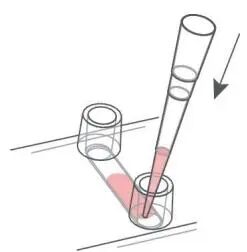
轻轻倾斜载玻片并敲击其侧边,以去除通道中可能残留的气泡。使用附带的盖子封闭两侧储液池。将载玻片连同载玻片滑架放入培养箱孵育 1 h,使细胞贴壁。
向每个储液池中小心注入 60 µL 无细胞培养基,防止引入气泡。
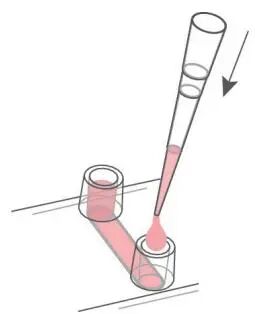
将载玻片连同载玻片滑架放入培养箱孵育过夜。
2、更换培养基:无断流更换法
使用移液器吸取储液池中的培养基,确保不触及并吸出通道内部的任何液体。轻轻地将 120 µL 无细胞培养基注入储液池中,以补充通道中的培养基。
在从对侧的储液池吸取旧培养基时,务必保持谨慎,以防移液操作冲走已贴壁的细胞或细胞团。每个储液池应使用 60 µL 无细胞培养基进行重新填充。
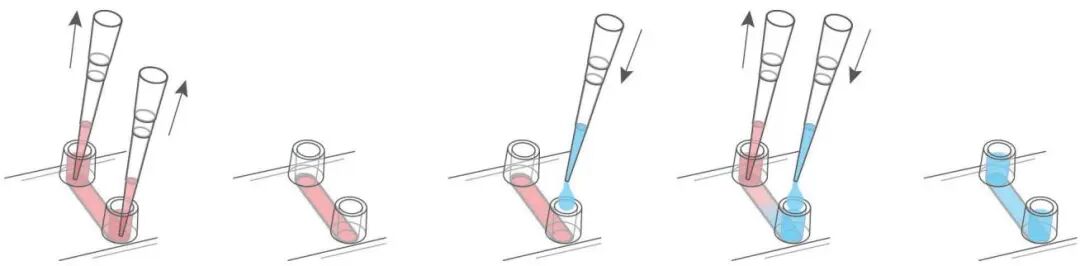
3、细胞固定、透化及封闭
采用无断流更换法(如上图所示),使用杜氏磷酸盐缓冲液替换细胞培养基以洗涤细胞。吸去大部分的杜氏磷酸盐缓冲液,但需保留一小部分以避免细胞损伤。
用 100 µL 10% 福尔马林固定细胞 20 min。
用 200 µL 杜氏磷酸盐缓冲液通过无断流更换法先后洗涤细胞 3 次。
吸去大部分的杜氏磷酸盐缓冲液,但需保留一小部分以避免细胞损伤。加入 100 µL 透化缓冲液,孵育细胞 5 min。
用 200 µL 杜氏磷酸盐缓冲液通过无断流更换法洗涤细胞。吸去大部分的杜氏磷酸盐缓冲液,但需保留部分体积以避免细胞损伤。
用 100 µL封闭缓冲液封闭细胞 20 min。
封闭完成后,再次使用 200 µL 杜氏磷酸盐缓冲液,通过无断流更换法洗涤细胞。
4、荧光染色
彻底排空储液池和通道内的杜氏磷酸盐缓冲液。
用 5 mL 注射器(此举可最.大程度地避免引入气泡)迅速将 30 µL iFluor 488 标记鬼笔环肽溶液加入到通道中。
避光孵育 20 min——自此时起,应确保样品处于持续的黑暗环境中。
使用 200 µL 杜氏磷酸盐缓冲液,通过无断流更换法先后洗涤细胞 2 次。
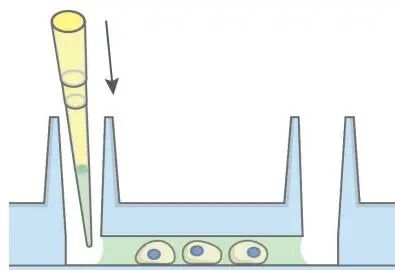
5、封片及成像
彻底排空储液池和通道内的杜氏磷酸盐缓冲液,随后立即注入含有 DAPI 的 ibidi 封片剂以进行细胞核染色,直至通道被完全填充。
将封片完毕后的载玻片 4°C 避光保存(至多可保存 4 周),直至进行镜检成像。
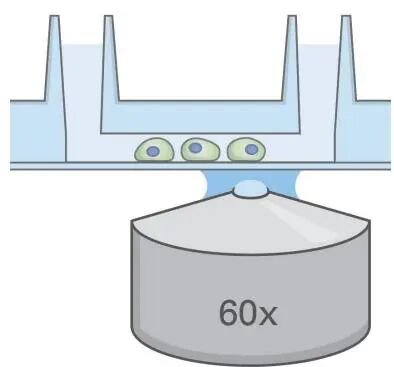
在荧光显微镜下使用适当的滤片组和 ibidi 镜油镜检。
如果你还需要做流体剪切实验或长期灌流(比如血管内皮细胞、肝细胞培养),推荐 ibidi μ-Slide I Luer 单通道载玻片,能精准控制流体环境,模拟体内生理条件,连接系统也特别方便!
ibidi µ-Slide VI 0.4 六通道载玻片,高通量多条件对比实验首推

ibidi μ-Slide I Luer 单通道载玻片,涉及流体剪切力或灌流培养等动态实验首.选