广州科适特科学仪器有限公司代理商
10 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.6000000000000001
- 1.6
- 0.6000000000000001
- 3.6
推荐产品
公司新闻/正文
生命之舟:血管生成如何塑造健康与疾病
1640 人阅读发布时间:2024-10-10 14:20
前言
血管生成——即从已存在的血管中分支形成新血管的过程——是一种对各种生理功能(包括组织修复和生长)至关重要的基本生物机制。虽然血管生成对于维持健康必不可少,但一旦失调,它也可能成为问题所在,加剧癌症和心血管疾病等疾病的进展。
了解血管生成在正常和病理环境中的作用一直是广泛研究的焦点。本博客深入探讨了多项研究,这些研究探索了血管生成对不同生物系统的影响。通过审视这些研究,我们得以洞察内皮细胞如何促进血管形成,以及当这一过程受到干扰时会产生什么后果。这些发现加深了我们对血管生物学的理解,并为潜在的治疗干预策略提供了指导——证明即使是最小的血管也可能产生重大影响。
血管生成在冠状动脉疾病风险中的作用
这篇由 Zhu 等人于 2022 年在《心血管研究》杂志上发表的研究,探讨了 ARHGEF26 基因位点与冠状动脉疾病(Coronary Artery Disease, CAD)之间的联系,CAD 是一种与动脉粥样硬化密切相关的疾病。血管生成,即新血管的形成,在 CAD 中发挥着复杂的作用,它导致斑块不稳定和炎症,进而推动疾病进展并增加血栓栓塞事件的风险。ARHGEF26 在这一过程中扮演了重要角色,促使研究人员探究该位点上的 DNA 变异如何通过内皮细胞(Endothelial Cells,ECs)中的血管生成信号影响 CAD。
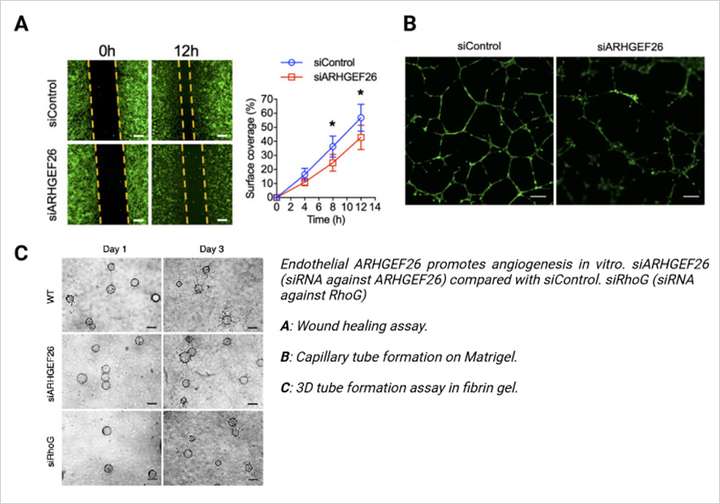
研究发现,ARHGEF26增强了内皮细胞中的促血管生成信号,并与涉及VEGF依赖性血管生成的途径相互作用,使其成为病理性血管形成的关键因素。研究人员采用体内和体外方法证明了ARHGEF26在血管生成中的作用。在体外实验中,通过伤口愈合实验、3D 纤维蛋白凝胶血管生成实验以及使用 µ-Plate 方形 96 孔板(ibidi,89626)进行的二维毛细血管管形成实验显示,敲低人主动脉内皮细胞(Human Aortic Endothelial Cells,HAECs)中的 ARHGEF26 显著损害了血管生成能力。
在体内实验中,ARHGEF26 对血管内皮生长因子(Vascular Endothelial Growth Factor, VEGF)依赖性血管萌发至关重要,在内皮细胞中敲除 ARHGEF26 导致动脉粥样硬化减轻和斑块稳定性改善。这表明 ARHGEF26 在介导动脉粥样硬化斑块内的病理性血管生成中发挥着关键作用。这些发现强调了 ARHGEF26 作为 CAD 潜在治疗靶点的价值,并指出了独立于传统降脂疗法之外,通过调节血管生成来稳定或消退斑块的机会。
肿瘤转移中的血管生成与内皮重塑
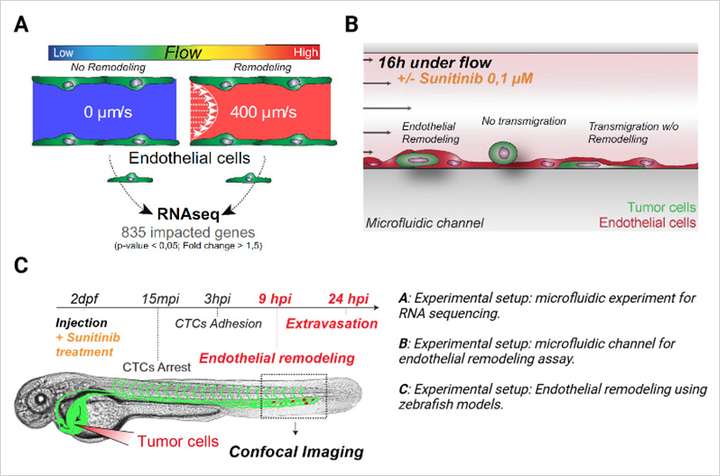
本研究探讨了血管生成相关通路如何影响循环肿瘤细胞(Circulating Tumor Cell,CTC)外渗过程中的内皮重塑,这是肿瘤转移的一个关键步骤。鉴于VEGFR信号在血管生成中的作用,研究人员推测,由血流诱导的 VEGFR 激活也会驱动内皮变化,从而促进肿瘤扩散。
转录组分析显示,暴露于血流导致与血管生成、血管发育和氧化应激相关的基因上调。当内皮细胞受到剪切力作用时,它们的重点从细胞分裂转向迁移和血管生成,这是血管重塑和肿瘤进展的关键过程。这种由血流诱导的剪切力启动了内皮出芽和迁移,这对于血管生成和转移都至关重要。
研究使用体外微流体装置和斑马鱼模型证明,VEGFR 抑制可减少内皮重塑,从而限制 CTC 逃逸至周围组织。通过使用 μ-Slide I Luer 通道载玻片(ibidi,80176)模拟生理剪切力条件,研究人员有效地展示了具有抗血管生成特性的 VEGFR 抑制剂舒尼替尼如何阻断对肿瘤进展至关重要的血流诱导的内皮变化。
这些发现由 Follain 等人于2021年发表在 Scientific Reports 期刊上,强调了靶向 VEGFR 依赖通路的治疗潜力。通过抑制血管生成和内皮重塑,这些通路为预防肿瘤转移提供了新的策略。
视网膜发育中的血管生成:Caspase-8 的作用
在 2019 年发表于The Journal of Clinical Investigation的一项研究中,Tisch 等人对 Caspase-8(Casp-8)及其在视网膜发育过程中血管生成的作用进行了研究。血管生成对于正常组织发育和修复以及病理状况(如早产儿视网膜病变 retinopathy of prematurity,ROP)至关重要。视网膜中的血管正常发育对于维持视力和整体眼部健康至关重要。
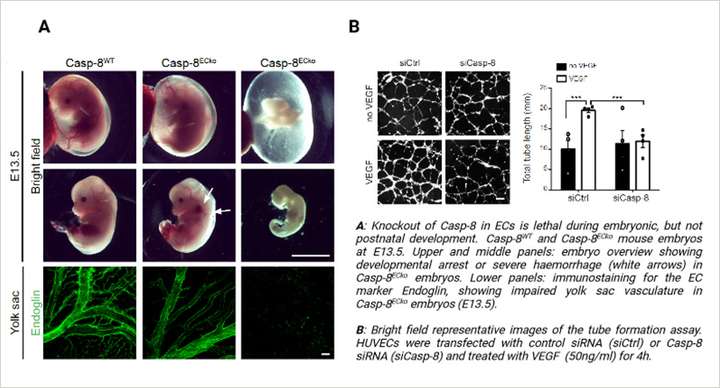
研究表明,Casp-8 对于视网膜血管正常生成至关重要。内皮细胞特异性 Casp-8 敲除(Casp-8ECKO)小鼠表现出视网膜血管生成显著减少,这归因于内皮细胞增殖、迁移和出芽受损。这些缺陷与 p38 MAPK 通路过度激活以及内皮细胞连接处血管内皮钙粘蛋白不稳定有关,这表明 Casp-8 在维持内皮细胞功能和稳定性方面发挥着重要作用,这一作用独立于其在凋亡或坏死性凋亡中的传统作用。
该研究还利用氧诱导视网膜病变(Oxygen-induced Retinopathy, OIR)模型进一步探索了病理性血管生成,该模型紧密模拟了早产儿视网膜病变。在该模型中,Casp-8ECKO 小鼠病理性新生血管减少,这表明 Casp-8 在调节过度血管生长方面发挥着重要作用。研究结果提出,靶向 Casp-8 可能为控制视网膜疾病中异常血管生成提供一种有前景的策略。
为评估血管生成活性,该研究进行了专业的体外实验,包括在 µ-Slide 血管生成载玻片(ibidi,81506)小室中进行的实验,以观察内皮细胞行为和血管生成。上述实验为 Casp-8 如何调节血管生成提供了见解。总体而言,该研究揭示了 Casp-8 在内皮细胞中的一种新的非凋亡功能,并提出了管理视网膜疾病中异常血管形成的潜在治疗策略。
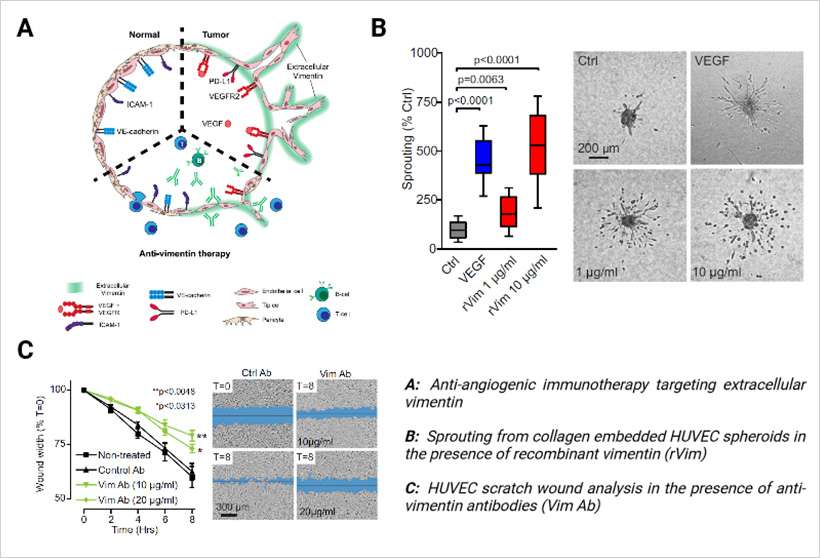
细胞外波形蛋白在肿瘤血管生成和免疫治疗中的作用
van Beijnum 等人在 Nature Communications 上最近发表的一项研究,探讨了细胞外波形蛋白在肿瘤血管生成中的作用,以及其作为抗血管生成免疫疗法靶点的潜力。研究发现,肿瘤内皮细胞不仅过度表达波形蛋白,还通过非传统机制分泌波形蛋白。这种细胞外波形蛋白通过激活 VEGFR2 来模拟血管内皮生长因子(Vascular Endothelial Growth Factor, VEGF)的作用,从而促进血管生成。它增强了内皮细胞的迁移、出芽和血管形成能力,同时也有助于免疫逃逸。
细胞外波形蛋白通过抑制白细胞黏附并增加内皮表面免疫检查点分子的表达来发挥作用。这些作用抑制了免疫反应,进一步促进了肿瘤进展。
研究表明,靶向细胞外波形蛋白在癌症治疗中可能非常有效。在临床前模型中,针对波形蛋白的单克隆抗体和疫苗接种策略显著抑制了血管生成和肿瘤生长。此外,这些疗法还通过改变肿瘤内免疫细胞的组成来增强抗肿瘤免疫力。
为了研究波形蛋白在血管生成中的作用,研究人员使用了专业测定法,包括内皮细胞球体出芽测定法和 Matrigel血管生成测定法,并利用 µ-Slide 8 孔高壁腔室载玻片(ibidi,80806)和 µ-Slide 玻璃底部血管生成载玻片(ibidi,81506)提供了波形蛋白对内皮细胞影响的详细见解。总体而言,该研究强调了细胞外波形蛋白在肿瘤血管生成和免疫抑制中的关键作用,并指出其作为改善癌症治疗策略的新型治疗靶点的潜力。
结语
本文所呈现的多项研究强调了血管生成在健康和疾病中的核心作用,揭示了它对从心血管功能、视网膜发育到癌症进展等异常过程的关键影响。通过探索调控血管生成的分子机制,如 ARHGEF26、VEGFR 信号传导、Caspase-8 和细胞外波形蛋白的作用,这些研究为靶向治疗干预开辟了新的途径。无论是在冠状动脉微血管疾病中预防异常血管生长、在癌症中抑制转移,还是管理视网膜疾病,加深对血管生成的理解都为开发更精确和有效的治疗方法带来了巨大希望。将这一领域的研究成果转化为应对医学挑战的临床策略,离不开持续的深入研究。