广州科适特科学仪器有限公司代理商
10 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.6000000000000001
- 1.6
- 0.6000000000000001
- 3.6
推荐产品
公司新闻/正文
ibidi µ-Pattern 区块载玻片上的细胞贴壁: 参数与优化
380 人阅读发布时间:2024-09-23 10:32
影响区块上细胞贴壁的关键因素
1)细胞类型
ibidi 区块培养技术成功应用于实验的关键在于选择适合的贴壁细胞类型,因为悬浮细胞无法有效贴壁到区块化表面。此外,由于不同细胞类型与各种结合区块的亲和力各异,细胞类型对 µ-Pattern 区块表面的贴壁具有显著的依赖性。因此,在开始实验之前,需验证所选细胞类型能否有效贴壁于区块表面。
2)结合位点
ibidi 区块培养技术提供了用于细胞贴壁的共价结合位点。这些结合位点表面密度可能与传统蛋白质涂层有所不同,因此可能会影响细胞的形态或贴壁行为。为了测试细胞与结合位点的兼容性,最佳方法是将细胞接种到具有较大贴壁面积的区块上(例如多细胞区块)。一旦细胞与区块的兼容性得到验证,便可进一步使用较小的区块,如单细胞区块。

图 1:μ-Pattern 提供的不同结合位点类型
3)区块的几何形状
区块的几何形状会因结合区块的数量而影响细胞的贴壁行为。例如,较小的区块上的结合位点较少,与较大的区块相比,可能会降低细胞的贴壁性。特别是在单细胞实验中,若希望实现区块上的单细胞占位,区块的大小非常重要,因为太小的区块会阻碍细胞的正常贴壁和扩散,而太大的区块则会导致多个细胞黏附在一个点上。此外,当间距过小不适合所用细胞类型时,黏附区块之间的间距会影响理想的细胞接种浓度以及细胞从一个点到另一个点的桥接。
4)细胞接种密度
细胞接种浓度是优化贴壁过程的另一个关键参数。接种浓度越低,区块上的细胞数量越少,或只有稀疏的细胞点,但结块现象越少。较高的细胞浓度可提高细胞覆盖率,但存在以下风险:
-
结块;
-
单细胞黏附点上出现多个细胞。
如果细胞浓度过高,细胞在贴壁到黏附点之前就开始聚集,这些漂浮的细胞多聚体可能会将贴壁的细胞从区块上剥离,从而阻止细胞进一步贴壁。
5)细胞悬液的质量
细胞悬液的均匀性对实验结果影响很大。进行单细胞检测时,最好使用不含任何细胞多聚体的单细胞悬液。在进行三维多细胞检测时,可选择加入细胞团或球状体悬液。
6)培养时间
细胞贴壁后的孵育时间会影响贴壁过程。细胞黏附到区块上所需的时间可能不同于其他表面。在贴壁过程中移动 ibidi µ-Pattern 区块载玻片时要特别小心,否则未贴壁或仅松散贴壁的细胞可能会开始结块。
7)剪切应力及洗涤
在特定的操作过程中,贴壁的细胞有可能受到机械力的作用而发生脱离,这种现象可用于有效清除未贴壁细胞或细胞碎片。洗涤的强度(即所施加的剪切应力)将直接影响被冲洗掉的细胞数量,剪切应力越大,脱离的细胞可能越多;反之,则越少。
8)细胞活力
细胞的活力和健康状态对于其正常贴壁具有显著影响。因此,优化细胞制备流程以减少细胞的环境胁迫显得尤为关键。应致力于优化和标准化那些影响细胞活力的因素,包括但不限于消化解离过程、温度控制、机械应力、悬浮时间的精确调控、培养基成分的优化以及其他细胞培养参数的精确设置。
优化细胞在 µ-Pattern 区块上的贴壁性
1)初步评估:验证细胞类型与 µ-Pattern 区块的兼容性
若不确定特定细胞类型是否与 µ-Pattern 结合区块兼容,建议首先利用多细胞 µ-Pattern 区块载玻片进行初步评估。通过在大面积区块上进行测试,可以减少对结合位点本身初始兼容性的直接评估,同时排除单细胞及区块几何形状对结果的潜在影响。
-
遵循操作指南,用 2~3 种不同浓度的细胞培养至少 4 h 至过夜,以确保细胞能在无干扰的环境下贴壁;
-
在洗去未贴壁的细胞之前,使用相差显微镜检测细胞贴壁情况——此时拍摄细胞图像有助于后续处理过程的优化;
-
洗涤后至少等待 2 h 再拍摄图像,以确保细胞从洗涤过程中可能产生的剪切应力中恢复。
注意:在此阶段,无需追求最佳的区块覆盖率。重要的是确保至少有部分细胞能够成功在区块上贴壁。若观察到细胞成功贴壁,则可继续优化所需区块的接种参数。若经过一夜孵育后,区块上仍未见细胞贴壁,则提示该细胞类型很可能与所使用的结合位点不兼容。
2)首次优化:针对 µ-Pattern 区块上细胞接种参数的优化
在明确了细胞与 µ-Pattern 区块的贴壁特性后,就可以着手进行所需区块的细胞接种参数的优化。请注意,由于区块的大小和间距对接种参数有显著影响,因此每种区块都需针对特定细胞类型进行个性化优化。务必确保细胞具有活力,并以单细胞悬液的形式进行接种。
首次优化试验流程:
-
遵循实验指导,在载玻片上接种至少三种不同浓度的细胞;
-
使细胞在无外界干扰条件下贴壁至少 4 h,然后进行洗涤;
-
在洗涤前后至少各拍摄一次细胞图像,确保每次拍摄间隔至少 2 h。
3)可能出现的实验结果 & 故障排除
-
洗涤后,细胞在区块上呈现良好的贴壁状态,区块覆盖率显著
您已成功确定适合实验的接种参数。接下来,您可以使用这些条件开始实验。
-
洗涤前,观察到细胞有少量漂浮和聚集现象;然而,洗涤后,贴壁于区块的细胞数量明显减少,区块覆盖率较低
这可能是由于细胞密度过低所致。建议提高细胞接种浓度,并考虑增加孵育时间,然后再洗去未贴壁细胞。
-
洗涤前,观察到大量细胞漂浮并聚集;洗涤后,区块上的细胞数量显著减少,区块覆盖率低
这提示细胞密度可能过高。建议降低初始接种浓度,因为高细胞密度常导致细胞聚集,从而阻碍细胞与区块的有效结合。此外,建议在接种细胞 2 h 和 3 h 后检查细胞状态,以评估缩短培养时间是否有助于减少细胞聚集,进而提高区块覆盖率。
-
洗涤后,区块上出现了不符合预期的细胞聚集现象
这暗示初始接种浓度可能过高或洗涤前的孵育时间过长。建议降低接种浓度,并在接种细胞 2 h 和 3 h 后检查细胞状态,以确定较短的孵育时间是否足以实现良好的细胞贴壁。
-
在使用小的单细胞点状区块或细线状区块时,区块上未见细胞贴壁,或细胞呈圆形且不扩散
若已知细胞能与区块中的结合位点结合,那么区块尺寸可能对于您的细胞类型而言过小,导致细胞无法充分扩散和贴壁。因此,建议在实验中使用更大的区块尺寸。
4)再次优化
-
基于首次优化的实验结果,采用已经优化过的细胞培养参数进行后续实验。
-
对比当前实验结果与首次优化后的实验结果,以评估优化效果;如有需要,则进行新一轮优化实验。
实验结果图像示例

图 2
图 2 示不同 L929 细胞浓度对单细胞区块贴壁的影响。将细胞分别以(A)1×10^5 cells/mL 、(B)3×10^5 cells/mL 、(C)5.25×10^5 cells/mL 的浓度接种到带有单细胞 µ-Pattern 区块的 µ-Slide VI 0.4 通道载玻片中。孵育 24 h后,洗去未贴壁的细胞,洗涤后 2 h 拍摄图像。在较低的接种浓度下,许多位点没有任何细胞覆盖;然而,当接种浓度过高时,细胞开始聚集在位点上。

图 3
图 3 示不同区块尺寸对 Rat1 细胞在单细胞区块上扩散行为的影响。在 ibidi µ-Slide VI 0.4 通道载玻片中以3×10^5 cells/mL 的浓度接种细胞,µ-Pattern 区块为(A)20 µm 方格,间距为 110 µm 或(B)30 µm 方格,间距为 110 µm。孵育 24 h 后,洗去未贴壁的细胞,洗涤后 2 h 拍摄图像。对于 Rat1 细胞来说,20 μm 的方格太小,细胞扩散不显著;而 30 μm 的方格则有足够的面积让细胞在区块上扩散。
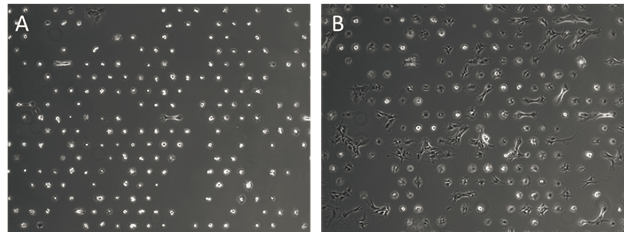
图 4
图 4 示区块几何形状对 NIH3T3 细胞在单细胞区块上扩散行为的影响。在 ibidi µ-Slide VI 0.4 通道载玻片上以 3×10^5 cells/mL 的浓度接种细胞,µ-Pattern 区块为(A)20 µm 方格,间距为 110 µm,或(B) 30 µm 方格,间距为 110 µm。孵育 24 h 后,洗去未贴壁的细胞,洗涤后 2 h 拍摄图像。对于 NIH3T3 细胞来说,20 μm 的方格太小,细胞扩散不显著;而 30 μm 的方格则有足够的面积让细胞在区块上扩散。不过,由于区块边缘之间的距离小了 10 μm,细胞能从一个点桥接到另一个点。对于这种细胞系,需要加大区块之间的距离。