广州科适特科学仪器有限公司代理商
10 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.6000000000000001
- 1.6
- 0.6000000000000001
- 3.6
推荐产品
公司新闻/正文
在 ibidi 96 孔黑色培养板中对由 iPS 细胞衍生的多巴胺能神经元进行免疫荧光染色
303 人阅读发布时间:2024-09-19 14:22
前言
诱导性多能干细胞(Induced Pluripotent Stem cells, iPS cells)在神经科学研究中广泛使用。这些细胞源自人类体细胞,经过转化成为增殖性多能细胞后,可以进一步分化成具有中脑多巴胺能表型的神经元。这些细胞在理解神经疾病细胞机制方面发挥着重要作用,并且在治疗帕金森病等神经退行性疾病方面显示出巨大潜力。
本应用指南描述了使用 ibidi µ-Plate 96 孔黑色培养板(ibidi,89626)对 iPS 细胞衍生的多巴胺能神经元进行免疫荧光染色的过程。请参考其他实验方案以了解如何由 iPS 细胞诱导生成多巴胺能神经元。

图 1:ibidi µ-Plate 96 孔黑色培养板(ibidi,89626)
材料与试剂
1)细胞与试剂
-
分化第 30 d 的 iPS 细胞衍生的多巴胺能神经元(原始 iPS 细胞系:1231A3)
-
iMatrix-511(Nippi)
-
Neurobasal 培养基(Thermo Fisher Scientific,21103049)
-
B27(Thermo Fisher Scientific,12587010)
-
Glutamax-I(Thermo Fisher Scientific,A1286001)
-
胶质细胞源性神经营养因子(GDNF,Wako)
-
抗坏血酸(Wako)
-
脑源性神经营养因子(BDNF,Wako)
-
二丁酰环磷腺苷酸(dbcAMP,Sigma-Aldrich)
-
Y-27632(Fujifilm)
-
多聚甲醛
-
磷酸盐缓冲液
-
普通驴血清
-
Triton X-100 透化剂
-
Tween 20
2)缓冲液与溶液
α. 神经分化培养基
-
Neurobasal培养基
-
B27(每 500 mL Neurobasal 培养基加入 10 mL B27)
-
2 mM Glutamax-I
-
10 ng/mL 胶质细胞源性神经营养因子
-
200 µM 抗坏血酸
-
20 ng/mL 脑源性神经营养因子
-
400 µM dbcAMP(二丁酰环磷腺苷酸)
-
20 µM Y-27632(在接种细胞时加入培养基中,以抑制由机械压力引起的细胞凋亡)
β. 封闭缓冲液
-
磷酸盐缓冲液
-
2~2.5% 普通驴血清
-
0.3%(体积分数)Triton X-100 透化剂
γ. 洗涤缓冲液
-
磷酸盐缓冲液
-
0.05%(体积分数)Tween-20
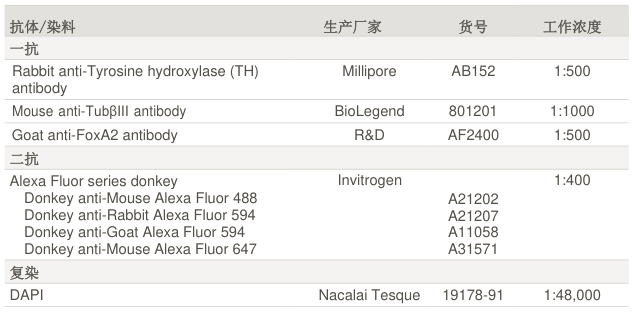
3)仪器与设备
-
ibidi µ-Plate 96 孔黑色培养板,经 ibiTreat 处理(ibidi,89626)
-
层流罩
-
培养箱(37°C,5% )
-
移液器及适配吸头
-
倒置显微镜(本实验使用 Keyence BZ-X710 显微镜)
实验步骤
1)样品制备
-
在无菌条件下执行所有步骤;
-
在每孔中加入以 90 µL 磷酸盐缓冲液稀释的 0.55µL(0.28 µg)iMatrix-511,在 37°C 下孵育 1~24 h,以覆盖培养板;
-
将 iPS 衍生的多巴胺能前体细胞以每孔 180µL 神经分化培养基的密度(即每孔含 个细胞)接种到 ibidi µ-Plate 96 孔黑色培养板上;
-
在 37°C 下孵育 iPS 细胞 7 d(即共分化 37 d);
-
每 2~3 d 轻轻更换一半的培养基——由于神经细胞容易从培养表面脱落,因此不建议更换全部培养基。
对于以下步骤,每孔均使用 90 µL 相应的缓冲液。若细胞在冰箱中冻存较长时间,建议在每孔中各加入180µL 磷酸盐缓冲液以补偿蒸发量。
2)固定
-
吸去细胞培养基。;
-
在每孔中加入适量 4% 多聚甲醛,并在 4°C 下孵育细胞 30 min;
-
吸去多聚甲醛;
-
在各孔中加入适量磷酸盐缓冲液。
建议立即继续下一步——不过,已固定的细胞可以在 4°C 下短时间存储。
3)透化及封闭
-
吸去磷酸盐缓冲液;
-
以封闭缓冲液室温孵育细胞 1 h。
4)一抗染色
-
将一抗以封闭缓冲液稀释,制得一抗染色溶液;
-
弃去封闭缓冲液,并立即进行下一步——切勿使得细胞干燥;
-
加入一抗染色溶液,室温孵育细胞过夜;
-
用洗涤缓冲液洗涤细胞 3 次。
5)二抗染色
-
将二抗以封闭缓冲液稀释,制得二抗染色溶液;
-
弃去封闭缓冲液;
-
加入二抗染色溶液,室温孵育细胞过夜;
-
用洗涤缓冲液洗涤细胞 2 次。
6)复染
-
将 DAPI 用磷酸盐缓冲液以 1:48,000 体积比稀释,制得复染溶液;
-
弃去洗涤缓冲液;
-
将复染溶液添加到细胞中,并在室温下孵育 10 min;
-
用洗涤缓冲液洗涤细胞 1 次;
-
以磷酸盐缓冲液填充各孔,并将样品避光保存直至镜检。
7)镜检成像
根据制造商给出的方案,使用荧光显微镜对细胞进行镜检成像。
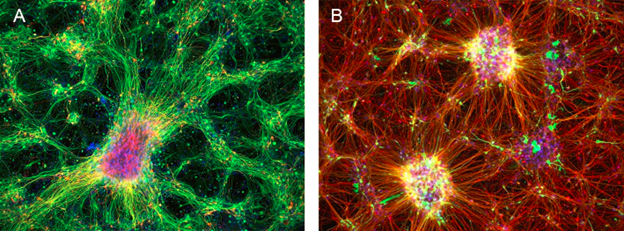
图 1:在ibidi µ-Plate 96孔黑色培养板中拍摄的人诱导多能干细胞(iPSCs)来源的多巴胺能神经元的免疫荧光图像。