广州科适特科学仪器有限公司代理商
10 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.6000000000000001
- 1.6
- 0.6000000000000001
- 3.6
推荐产品
公司新闻/正文
在单向灌流条件下进行细胞黏附实验
232 人阅读发布时间:2024-09-09 09:53
前言
本应用指南阐述了一种在灌流条件下进行细胞黏附实验的方案,旨在探究特定细胞表面分子在细胞间附着与黏附过程中扮演的角色,及其潜在的相互作用机制。
实验过程中,实验者采用了预先荧光标记的鼠源多发性骨髓瘤细胞(multiple myeloma,MM)与鼠源内皮细胞(endothelial cells,EC)作为实验对象。随后,利用单克隆抗体特异性地阻断研究者所关注的某一特定分子,以探究其在细胞相互作用中的功能。具体而言,内皮细胞首先被接种至 ibidi μ-Slide I 0.6 Luer 通道载玻片中,并持续灌流培养 24 h,以模拟生理环境下的细胞行为。

图 1: ibidi µ-Slide I 0.6 Luer 通道载玻片。
接下来,将已标记的细胞鼠源多发性骨髓瘤细胞加入灌流培养装置中,并持续灌流培养。经共培养 24 h 后,实验组样本通过添加特异性抗体以阻断目标分子,而对照组则采用相应的同种型对照抗体处理,两者均继续灌流培养 24 h。
实验次日,将通道载玻片从流体单元上取下并洗涤,以除去未黏附的鼠源多发性骨髓瘤细胞。最后,用共聚焦显微镜对载玻片通道区域进行成像,以分析并量化鼠源多发性骨髓瘤细胞对鼠源内皮细胞的黏附情况,从而揭示特定细胞表面分子在细胞间相互作用中的具体作用机制。
材料与试剂
-
MOPC 多发性骨髓瘤细胞系 (ATCC, TIB-23™)
-
EOMA 内皮细胞系 (ATCC, CRL-2586™)
-
RPMI 培养基(Fisher Scientific,11530586),含 10% 胎牛血清
-
内皮细胞生长培养基(CellBiologics,M1168)
-
磷酸盐缓冲液(PAN-Biotech,P04-361000)
-
非酶细胞解离液(Sigma-Aldrich,C5914-100ML)
-
台盼蓝溶液(Sigma-Aldrich,93595)
-
CellTracker™Green CMFDA 染液(ThermoFisher,C7025)
仪器与耗材
-
具有 2 个流体单元的 ibidi 流体剪切力系统,2 个流体单元需配备有 2 mL 储液器支架(ibidi,10977)
-
ibidi μ-Slide I 0.6 Luer 通道载玻片,经 ibiTreat 处理(ibidi,80186)
-
ibidi 蓝色灌流管,长 15 cm,内径 0.8 mm(ibidi,10961)
-
ibidi 滤器-2 mL 储液器套装(ibidi,10972)
-
具有细胞培养设备的层流罩
-
培养箱(所有培养步骤均需在 37°C、5% 二氧化碳条件下进行)
-
配备有相应滤片组以及摄像机的荧光显微镜
实验步骤
注意!本实验中灌流培养基的粘度取0.0072 dyn·s/cm2。
1)制备 EOMA 细胞悬液
使用非酶细胞解离液解离先前培养的 EOMA 细胞,使用 Neubauer 血细胞计数板对细胞进行计数。随后用内皮细胞生长培养基将细胞密度调整至1.2×106 cells/mL。
2)接种 EOMA 细胞
取 3 片通道载玻片,在每片载玻片中加入 150 μL 上述 EOMA 细胞悬液(即在每片载玻片中加入 1.75×105个 EOMA 细胞),随后在 37°C、5% 条件下培养 3 h。
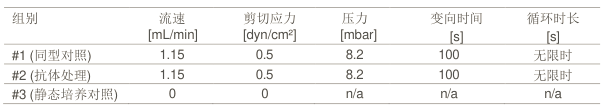
表 1:各组别实验参数设置。
3)灌流培养
接种 EOMA 细胞 3 h 后,将 2 片通道载玻片连接到流体单元上(需加入共 2.7 mL 内皮细胞生长培养基),压力设为 8.2 mbar,细胞表面的剪切应力设为0.5dyn/cm2(详见表 1)。
将 2 个流体单元连同 2 片通道载玻片 37°C、5%二氧化碳孵育过夜;载有 EOMA 细胞的第 3 片通道载玻片则用作静态培养对照,在无灌流(即静态培养)条件下 37°C、5% 二氧化碳孵育过夜。
4)制备多发性骨髓瘤细胞
用 RPMI 培养基(不含胎牛血清) 将多发性骨髓瘤细胞制备成 1×106 cells/mL 悬液,随后取 600 μL,按照生产厂家提供的相关指引,用 CellTracker™Green CMFDA 染液染色。染色完毕后,离心细胞并使用 Neubauer 血细胞计数板计数。
5)多发性骨髓瘤细胞-内皮细胞共培养
中止灌流并在无菌条件下从流体单元储液器中移除内皮细胞生长培养基。随后,将 RPMI 培养基(含 10% 胎牛血清)与内皮细胞生长培养基以 1:1 体积比混合,并将混合液(总体积为 2.5 mL,含 1×105 个多发性骨髓瘤细胞)等量加入两个流体单元的储液器中,最后重新将流体单元与流体剪切力系统并继续灌流培养 24 h。
6)分子封闭
将多发性骨髓瘤细胞与内皮细胞共培养 24 h 后,直接将抗体(载玻片 2)或相应的同型对照抗体(载玻片 1)加入到流体单元的对应储液器中处理细胞(无需更换培养基),随后继续灌流培养 24 h。
7)洗涤及成像
将通道载玻片从流体单元上断开。用磷酸盐缓冲液洗涤细胞 1 次,以去除所有未黏附细胞。使用共聚焦显微镜获取荧光图像,以观察黏附在内皮细胞层上的荧光标记多发性骨髓瘤细胞。

图 2:与同型对照处理(左图)相比,在阻断特定表面分子(右图)时,多发性骨髓瘤细胞对内皮细胞的黏附减少。