广州科适特科学仪器有限公司代理商
10 年
手机商铺
- NaN
- 0.6000000000000001
- 1.6
- 0.6000000000000001
- 3.6
推荐产品
公司新闻/正文
让 3D 细胞培养「排兵布阵」:ibidi 多细胞 μ-Pattern ibiTreat 微区块化表面载玻片
202 人阅读发布时间:2025-09-30 15:19
前言:
ibidi 多细胞 μ-Pattern ibiTreat 微区块化表面载玻片(µ-Slides With Multi-Cell µ-Pattern ibiTreat)是一款专为多细胞体系研究设计的微区块化载玻片,通过精密微加工技术在玻璃表面构建规则细胞粘附区域,为肿瘤细胞球状体、类器官或共培养实验提供标准化的 3D 细胞排列环境。其独特的微区块设计不仅优化了细胞间距(适配 50~500 μm 直径结构),更通过纳米级拓扑引导实现细胞自主定位,显著提升多细胞相互作用研究的可控性。
在 ibidi 多细胞 μ-Pattern ibiTreat 微区块化表面载玻片中培养的细胞。
该产品搭载高透光性成像腔室,支持长时间高分辨率荧光显微观测,结合免预处理特性(即拆即用型包装)可大幅缩短实验准备周期。含标准化操作流程与质控参数,助力快速开展药物筛选、细胞迁移或信号传导研究。这款载玻片通过「结构-功能」一体化设计,正在重新定义多细胞体外模型的构建标准,为再生医学、肿瘤生物学等领域提供高效精准的表型分析解决方案。
实验原理:
ibidi 的 µ-Patterning 微区块技术为细胞球状体及类器官研究提供了具有空间限定性的细胞粘附解决方案。该技术借助不可逆印刷工艺,在 ibidi 聚合物盖玻片的生物惰性表面上构建微型化黏附区块,从而实现细胞贴壁位置的精准调控。这些微区块具备干燥稳定性、无菌性且即拆即用。在相差显微镜下,ibiTreat 微区块可见轻微痕迹,但在荧光显微观察中则完全看不见。
ibiTreat 表面处理工艺具备强大通用性:绝大多数贴壁细胞无需额外涂层即可在其表面良好生长。作为 ibidi 聚合物盖玻片的亲水版本,ibiTreat 表面经过与标准细胞培养器皿相似的组织培养处理(TC 处理),使其具备亲水特性,几乎适用于所有细胞类型的贴壁。
与 ibidi 微区块化载玻片类似,ibiTreat 表面可轻松进行特异性蛋白涂层修饰,满足多样化实验需求。
从微区块设计、生物惰性表面处理到聚合物盖玻片材质,所有 ibidi 载玻片底部均针对高分辨率显微成像需求优化,为细胞动态观察提供清晰可视化的技术保障。
技术特色:
此款 µ-Slide 载玻片采用独特的复合表面设计:中央为 ibiTreat 微区块化粘附区域,其周围环绕着 ibidi 生物惰性表面。得益于生物惰性区域的强大生物惰性,即使经过数天至数周的长周期培养,细胞仍被严格限制在微区块区域内生长,彻底杜绝非特异性粘附。
与传统超低粘附(ULA)表面相比,ibidi 生物惰性表面展现出三大核心优势:
- 零粘附特性:完全排斥细胞及蛋白附着
- 长效稳定性:生物惰性效果持续整个实验周期
- 生物惰性:无细胞毒性,确保实验体系纯净
该载玻片以 ibidi 聚合物盖玻片为基底材料,结合多层生物惰性涂层技术,在保证最高光学质量的同时,可适配高分辨显微成像需求。微区块采用非荧光材料印制,在相差显微镜下仅略微可见,从而避免干扰荧光成像。
本品所有材料均通过全面生物相容性验证,兼容各类染色与固定流程。此外,还可提供整合 RGD 结合基序的定制版本,满足细胞-基质相互作用研究需求。
应用范围:
多维细胞模型构建与观察
-
支持 3D 细胞聚集体或 2D 细胞片状单层的培养与成像分析;
-
适用于细胞球状体、类器官、胚状体及干细胞的显微镜动态监测与研究。
-
提供无支架依赖的 3D 细胞模型培养环境,兼容成像观察;
-
可模拟体内微环境进行细胞自组装行为研究。
生理应力模拟培养
-
通过 µ-Slide VI 0.4 通道载玻片版本实现灌注流场与剪切应力条件下的 3D 细胞聚集体培养;
-
适用于血管生成、肿瘤微环境等力学敏感型研究。
高级显微成像支持
-
适配活细胞长时间动态成像及多通道荧光显微观察; -
支持对活细胞或固定样本进行免疫荧光染色后的高分辨率显微分析。
微区块化培养表面的应用范围
微区块化培养表面是优化 3D 细胞分析的高效工具,其通过限定空间内的精准定位,实现对单个细胞球状体或类器官的独立研究。ibidi µ-Slide 载玻片采用平底结构设计与生物惰性技术相结合,在保证卓越光学性能的同时,可适配高分辨率荧光显微镜下的 3D 细胞培养实验需求。
ibidi 多细胞 μ-Pattern ibiTreat 微区块化表面载玻片支持 3 种核心应用场景:
- 原位构建三维结构:可直接在微区块表面接种细胞悬液,诱导细胞球状体或类器官定向形成;
- 转移培养预成型体:兼容预生成细胞球状体的转移与固定,便于对成熟 3D 结构进行后续分析;
- 二维限定培养:支持在精确几何边界内培养单层细胞,为细胞迁移、形态学等研究提供标准化平台。
该区块化设计既保留了传统 2D 培养的易操作性,又融合了 3D 模型的生理相关性,为药物筛选、细胞相互作用等复杂研究提供灵活解决方案。
1.细胞球状体相关应用
图3将 L929 细胞接种于 ibidi 微区块化表面(ibiTreat µ-Pattern)的 µ-Slide VI 0.4 通道载玻片中进行为期 23 d 的静态培养。实验设置 3 种培养表面条件:无包被的微区块化表面、经层粘连蛋白包被的微区块化表面、经胶原蛋白 I 包被的微区块化表面。在相差显微镜 4× 物镜下连续观察并记录由第 1 d(左图)至第 23 d(右图)的细胞球状体形成过程。图中比例尺为 200 μm。
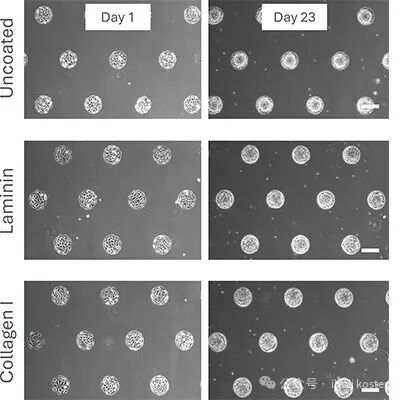
图3

对生长在经层粘连蛋白包被的 ibidi 微区块化表面上的 L929 小鼠成纤维细胞球状体进行 3D 体积扫描。实验采用 DAPI 染色标记细胞核(品红色),Phalloidin-Atto 488 染色标记 F-肌动蛋白(绿色),并通过 Prospective Instruments 公司生产的 MPX 多光子显微镜进行深度成像。
2.细胞单层相关应用
如图 4所示,在具有 ibidi 微区块化表面的 ibidi μ-Slide VI 0.4 通道载玻片中培养 L929 小鼠成纤维细胞单层。细胞直接接种于无包被的微区块化表面,或接种于经层粘连蛋白、胶原蛋白 I 包被的微区块化表面。接种 25 h 后通过相差显微镜配合 4× 物镜进行成像(左图为全视野,右图为单个细胞覆盖区域的特写)。图中比例尺为 200 μm。

图4
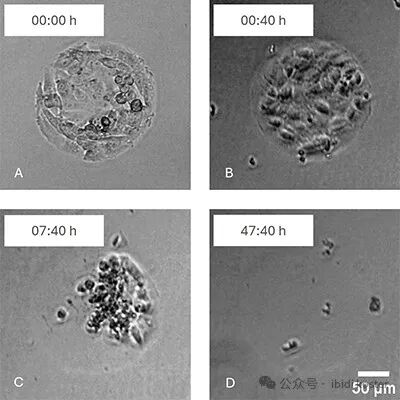
如图5所示,在经胶原蛋白 I 包被的 ibidi 多细胞微区块化表面(Multi-Cell Pattern ibiTreat)培养 RCC26 肾癌细胞系,并记录加入 T 细胞后不同时间点的细胞杀伤效应:
- 图 A:T 细胞添加前;
- 图 B:T 细胞添加后 40 min;
- 图 C:T 细胞添加后 7 h 40 min;
- 图 D:T 细胞添加后 47 h 40 min。